Bạn muốn biết cách xác định số lớp electron trong một nguyên tử? Bài viết này sẽ hướng dẫn bạn từng bước cách tìm hiểu và xác định số lớp electron, giúp bạn nắm vững kiến thức cơ bản về cấu trúc nguyên tử và các lớp electron, từ đó áp dụng vào việc học tập và nghiên cứu.
Lớp electron là gì?
Lớp electron, còn được gọi là quỹ đạo electron, là vùng không gian bao quanh hạt nhân nguyên tử, nơi các electron có thể xuất hiện và di chuyển. Trong mỗi nguyên tử, các electron được tổ chức thành từng lớp, và mỗi lớp chỉ có thể chứa một số lượng electron nhất định theo các quy tắc cụ thể.
Số lớp electron
Trong cấu trúc nguyên tử, các electron được sắp xếp theo các lớp khác nhau, với mỗi lớp nằm cách hạt nhân một khoảng cách nhất định. Các electron trong cùng một lớp có mức năng lượng tương tự nhau.
Electron ở lớp gần hạt nhân nhất có liên kết mạnh hơn so với các electron ở lớp xa hơn. Vì vậy, electron ở những lớp gần hạt nhân có mức năng lượng thấp hơn so với những electron ở lớp ngoài. Mức năng lượng của electron chủ yếu phụ thuộc vào vị trí lớp của chúng trong nguyên tử.
Nguyên tử có thể chứa tới 7 lớp electron, được đánh số lần lượt từ n = 1, 2, 3,…, 7.
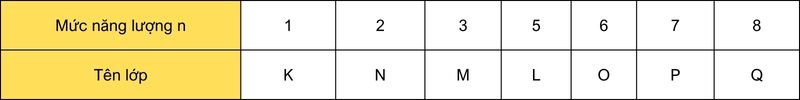
Trong đó, lớp K với n=1 là lớp gần hạt nhân nhất và lớp Q với n=7 là lớp xa hạt nhân nhất.
Phân lớp electron
Phân lớp electron là các nhóm electron trong cùng một lớp nhưng có mức năng lượng khác nhau. Các phân lớp được ký hiệu bằng các chữ cái s, p, d và f. Mỗi phân lớp có một số lượng tối đa electron cụ thể:
- Phân lớp s: chứa tối đa 2 electron
- Phân lớp p: chứa tối đa 6 electron
- Phân lớp d: chứa tối đa 10 electron
- Phân lớp f: chứa tối đa 14 electron
Trong mỗi lớp, các phân lớp được sắp xếp theo mức năng lượng tăng dần. Ví dụ, lớp thứ hai (n=2) có hai phân lớp: 2s và 2p. Phân lớp 2s có mức năng lượng thấp hơn phân lớp 2p.
Cấu trúc electron của một nguyên tử được xác định bởi sự sắp xếp của các electron trong các lớp và phân lớp này. Sự sắp xếp này tuân theo quy tắc Hund và quy tắc cấu hình electron, đảm bảo rằng các electron chiếm các vị trí có mức năng lượng thấp nhất trước.
Xem thêm>> So sánh vật thể tự nhiên và vật thể nhân tạo
Cách xác định số lớp electron

Cách xác định số lớp electron
Để xác định số lớp electron của một nguyên tử, bạn cần biết số hiệu nguyên tử (số proton) của nguyên tố đó và hiểu cách các electron được phân bố trong các lớp năng lượng. Dưới đây là cách xác định số lớp electron:
Sử dụng bảng tuần hoàn các nguyên tố:
Số lớp electron của một nguyên tố tương đương với số chu kỳ (hàng ngang) mà nguyên tố đó nằm trong bảng tuần hoàn.
Ví dụ: Natri (Na) nằm ở chu kỳ 3, do đó nó có 3 lớp electron.
Phân bố electron theo các lớp năng lượng:
Các electron được sắp xếp vào các lớp năng lượng từ lớp thấp nhất đến lớp cao nhất theo thứ tự: 1, 2, 3, 4, 5, 6, 7.
Số electron tối đa trong mỗi lớp được xác định theo công thức 2n2, trong đó n là số thứ tự của lớp. Ví dụ, lớp thứ nhất có thể chứa tối đa 2 electron, lớp thứ hai chứa tối đa 8 electron, và lớp thứ ba chứa tối đa 18 electron.
Phân bố electron theo các lớp cụ thể:
Bắt đầu từ lớp thứ nhất và đi lên, bạn phân bố số electron cho từng lớp cho đến khi hết số electron của nguyên tử.
Ví dụ: Nguyên tử natri (Na) có 11 electron. Phân bố electron sẽ là: Lớp thứ nhất có 2 electron, lớp thứ hai có 8 electron, và lớp thứ ba có 1 electron. Như vậy, natri có 3 lớp electron.
Ví dụ Cụ thể
Nguyên tử Helium (He):
- Số proton (cũng là số electron): 2
- Phân bố electron: Lớp thứ nhất (n=1) có 2 electron.
- Số lớp electron: 1
Nguyên tử Carbon (C):
- Số proton (cũng là số electron): 6
- Phân bố electron: Lớp thứ nhất (n=1) có 2 electron, lớp thứ hai (n=2) có 4 electron.
- Số lớp electron: 2
Nguyên tử Calcium (Ca):
- Số proton (cũng là số electron): 20
- Phân bố electron: Lớp thứ nhất (n=1) có 2 electron, lớp thứ hai (n=2) có 8 electron, lớp thứ ba (n=3) có 8 electron, lớp thứ tư (n=4) có 2 electron.
- Số lớp electron: 4
Cách xác định lớp electron ngoài cùng
Cách xác định lớp electron ngoài cùng
Sử dụng bảng tuần hoàn các nguyên tố:
Nguyên tố thuộc nhóm nào trong bảng tuần hoàn sẽ có số electron hóa trị tương ứng với số thứ tự của nhóm đó.
Ví dụ:
- Nhóm 1 (IA): Các nguyên tố như Li, Na, K đều có 1 electron ở lớp ngoài cùng.
- Nhóm 2 (IIA): Các nguyên tố như Be, Mg, Ca đều có 2 electron ở lớp ngoài cùng.
- Nhóm 17 (VIIA): Các nguyên tố như F, Cl, Br đều có 7 electron ở lớp ngoài cùng.
- Nhóm 18 (VIIIA): Các nguyên tố khí hiếm như He, Ne, Ar đều có 8 electron (ngoại trừ He có 2 electron).
Phân bố electron theo lớp năng lượng:
- Bắt đầu từ lớp thứ nhất và đi lên, phân bố số electron cho từng lớp cho đến khi hết số electron của nguyên tử.
- Lớp cuối cùng có electron chính là lớp ngoài cùng.
Ví dụ cụ thể
Nguyên tử Natri (Na):
- Số proton (số electron): 11
- Phân bố electron: Lớp thứ nhất (2 electron), lớp thứ hai (8 electron), lớp thứ ba (1 electron).
- Lớp ngoài cùng: Lớp thứ ba với 1 electron.
Nguyên tử Oxy (O):
- Số proton (số electron): 8
- Phân bố electron: Lớp thứ nhất (2 electron), lớp thứ hai (6 electron).
- Lớp ngoài cùng: Lớp thứ hai với 6 electron.
Nguyên tử Canxi (Ca):
- Số proton (số electron): 20
- Phân bố electron: Lớp thứ nhất (2 electron), lớp thứ hai (8 electron), lớp thứ ba (8 electron), lớp thứ tư (2 electron).
- Lớp ngoài cùng: Lớp thứ tư với 2 electron.
- Tính chất của lớp electron ngoài cùng
- Tính chất hóa học: Các electron trong lớp ngoài cùng quyết định khả năng phản ứng hóa học của nguyên tố. Ví dụ, các nguyên tố kim loại kiềm (nhóm 1) có 1 electron ở lớp ngoài cùng và dễ dàng mất electron này để tạo thành ion dương (cation).
- Liên kết hóa học: Các nguyên tố có xu hướng đạt được cấu hình electron ổn định (giống khí hiếm) bằng cách mất, nhận hoặc chia sẻ electron. Ví dụ, natri (Na) có xu hướng mất 1 electron để đạt cấu hình bền vững của neon (Ne)