Cấu trúc nguyên tử là nền tảng của hóa học và vật lý, đóng vai trò quan trọng trong việc hiểu bản chất của vật chất. Bài viết này tổng hợp lý thuyết và bài tập về cấu trúc nguyên tử, bao gồm các khái niệm cơ bản như hạt nhân, electron, mô hình nguyên tử của Bohr và các thuyết hiện đại. Qua đó, bạn sẽ nắm vững kiến thức cần thiết và có thể áp dụng hiệu quả vào việc học tập và các ứng dụng thực tế.
Khái niệm về nguyên tử

Nguyên tử là đơn vị cơ bản và nhỏ nhất của một nguyên tố hóa học
Nguyên tử là đơn vị cơ bản và nhỏ nhất của một nguyên tố hóa học, có thể tham gia vào các phản ứng hóa học. Nguyên tử bao gồm một hạt nhân ở trung tâm và các electron di chuyển xung quanh hạt nhân trong các đám mây điện tử hoặc các quỹ đạo.
Cấu trúc của nguyên tử:
Hạt nhân:
- Nằm ở trung tâm của nguyên tử, chứa các hạt proton và neutron.
- Proton mang điện tích dương, neutron không mang điện tích.
- Số proton trong hạt nhân xác định nguyên tố và được gọi là số nguyên tử.
Electron:
- Di chuyển xung quanh hạt nhân trong các quỹ đạo hoặc đám mây điện tử.
- Mang điện tích âm và có khối lượng rất nhỏ so với proton và neutron.
- Số electron bằng số proton trong nguyên tử trung hòa về điện.
Các mô hình nguyên tử

Tìm hiểu các mô hình nguyên tử phổ biến
Mô hình hành tinh của Rutherford:
- Hạt nhân ở trung tâm, các electron quay quanh hạt nhân như các hành tinh quay quanh Mặt Trời.
- Mô hình này gặp hạn chế vì không giải thích được sự ổn định của electron.
Mô hình Bohr:
- Electron di chuyển trên các quỹ đạo xác định quanh hạt nhân.
- Electron chỉ tồn tại ở những quỹ đạo có năng lượng xác định và không phát xạ năng lượng khi ở trên các quỹ đạo này.
- Electron chuyển từ quỹ đạo này sang quỹ đạo khác sẽ phát ra hoặc hấp thụ năng lượng dưới dạng photon.
Mô hình cơ học lượng tử:
- Electron không di chuyển theo quỹ đạo xác định mà tồn tại trong các đám mây điện tử với xác suất có mặt ở những vị trí nhất định quanh hạt nhân.
- Mô hình này giải thích chính xác hơn các tính chất và hành vi của electron.
Nguyên tử là khối xây dựng cơ bản của mọi vật chất và hiểu biết về cấu trúc nguyên tử giúp chúng ta hiểu sâu hơn về các phản ứng hóa học, tính chất vật lý và nhiều hiện tượng khác trong tự nhiên.
Xem thêm>>>Tổng hợp kiến thức định luật truyền thẳng ánh sáng
Bảng so sánh nguyên tử và phân tử
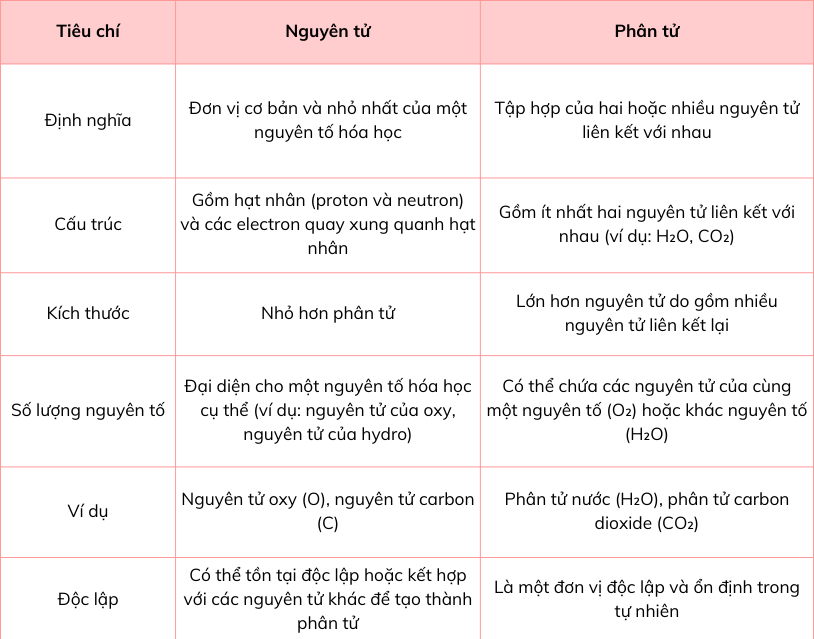
Bảng so sánh nguyên tử và phân tử
Bài tập trắc nghiệm về cấu trúc nguyên tử
Bài 1:
Thành phần nào của nguyên tử quyết định tính chất hóa học của nguyên tố?
- a) Proton
- b) Neutron
- c) Electron
- d) Hạt nhân
Đáp án: c) Electron
Bài 2:
Hạt nhân của một nguyên tử được cấu thành từ:
- a) Electron và neutron
- b) Proton và electron
- c) Proton và neutron
- d) Chỉ có neutron
Đáp án: c) Proton và neutron
Bài 3:
Số lượng proton trong hạt nhân của một nguyên tử được gọi là:
- a) Số khối
- b) Số nguyên tử
- c) Số neutron
- d) Số điện tích
Đáp án: b) Số nguyên tử
Bài 4:
Nguyên tử nào sau đây có cùng số proton nhưng khác số neutron?
- a) Đồng vị
- b) Ion
- c) Phân tử
- d) Hợp chất
Đáp án: a) Đồng vị
Bài 5:
Hạt nào sau đây có khối lượng nhỏ nhất trong nguyên tử?
- a) Proton
- b) Neutron
- c) Electron
- d) Hạt nhân
Đáp án: c) Electron
Bài 6:
Cấu hình electron của nguyên tử nào sau đây là đúng?
- a) 1s² 2s² 2p⁶
- b) 1s² 2s² 2p⁷
- c) 1s² 2s² 3s²
- d) 1s² 2p⁶ 3s²
Đáp án: a) 1s² 2s² 2p⁶
Bài 7:
Trong mô hình nguyên tử của Bohr, electron di chuyển theo quỹ đạo nào?
- a) Quỹ đạo hình elip
- b) Quỹ đạo hình tròn
- c) Quỹ đạo tự do
- d) Quỹ đạo xác suất
Đáp án: b) Quỹ đạo hình tròn
Bài 8:
Khi electron chuyển từ mức năng lượng cao về mức năng lượng thấp, hiện tượng nào xảy ra?
- a) Hấp thụ năng lượng
- b) Phát ra năng lượng
- c) Không thay đổi năng lượng
- d) Biến mất
Đáp án: b) Phát ra năng lượng
Bài 9:
Nguyên tố X có số proton là 11, số neutron là 12. Số khối của nguyên tố X là:
- a) 11
- b) 12
- c) 23
- d) 24
Đáp án: c) 23
Bài 10:
Cấu hình electron của nguyên tử natri (Na) là:
- a) 1s² 2s² 2p⁶ 3s¹
- b) 1s² 2s² 2p⁵ 3s²
- c) 1s² 2s² 2p⁶
- d) 1s² 2s² 3p⁶
Đáp án: a) 1s² 2s² 2p⁶ 3s¹