Đề thi hóa chuyên vào lớp 10
Bộ đề thi vào lớp 10 chuyên Hóa năm 2021 có đáp án
tiengtrungquoc.edu.vn biên soạn và sưu tầm Bộ đề thi vào lớp 10 chuyên Hóa năm 2021 có đáp án được các Thầy/Cô giáo nhiều năm kinh nghiệm biên soạn và tổng hợp chọn lọc từ đề thi môn Hóa vào lớp 10 của các trường THPT trên cả nước sẽ giúp học sinh có kế hoạch ôn luyện từ đó đạt điểm cao trong kì thi tuyển sinh vào lớp 10 môn Hóa.
Bạn đang xem: Đề thi hóa chuyên vào lớp 10

Sở Giáo dục và Đào tạo .....
Trường THPT ....
Kì thi tuyển sinh vào lớp 10
Năm học 2021
Môn: Hóa học (khối chuyên)
Thời gian làm bài: 120 phút
(Đề thi số 1)
Câu 1. (2 điểm)
a/ Tại sao CO2 được dùng để giập tắt đám cháy?
b/ Viết phương trình phản ứng và giải thích các hiện tượng hóa học sau:
- Trong tự nhiên có nhiều nguồn tạo ra H2S nhưng lại không có sự tích tụ H2S trong không khí.
- Trong phòng thí nghiệm, khi nhiệt kế thủy ngân bị vỡ người ta dùng bột lưu huỳnh rắc lên nhiệt kế bị vỡ.
- Trong phòng thí nghiệm bị ô nhiễm khí Cl2, để khử độc người ta xịt vào không khí dung dịch NH3.
Câu 2. (2 điểm)
1. Cho hỗn hợp X gồm Al2O3, MgO, Fe, Cu vào dung dịch HCl dư thu được dung dịch Y, khí Z và chất rắn A. Hòa tan A trong dung dịch H2SO4 đặc, nóng, dư thu được khí B. Sục từ từ khí B vào dung dịch nước vôi trong dư thu được kết tủa D. Cho từ từ dung dịch NaOH đến dư vào dung dịch Y thì thu được chất rắn E. Nung E trong không khí đến khối lượng không đổi thu được chất rắn G. Xác định thành phần các chất trong Y, Z, A, B, D, E, G. Biết các phản ứng xảy ra hoàn toàn.
2. Cho hỗn hợp khí gồm CO2, C2H4, C2H2, C2H6. Trình bày phương pháp hóa học để tách riêng từng khí ra khỏi hỗn hợp .
Câu 3. (2 điểm)
1. Cho các hóa chất và dụng cụ gồm: Canxi cacbua, nước cất, nước brom, ống nghiệm có nhánh, ống nghiệm, ống dẫn, nút cao su, ống nhỏ giọt, chậu thủy tinh, giá đỡ. Trình bày các bước tiến hành thí nghiệm, nêu hiện tượng, viết phương trình hóa học cho các thí nghiệm sau :
-Điều chế khí axetilen.
-Thu khí axetilen.
-Phản ứng cộng của axetilen.
2.
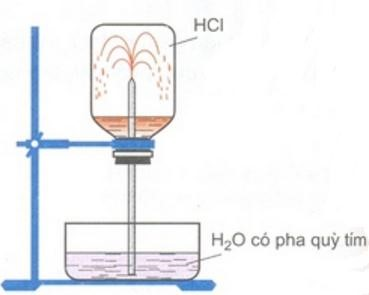
Hình trên chứng minh tính chất vật lí gì của khí hiđroclorua? Giải thích hiện tượng trên.
Câu 4. (2 điểm)
Hoà tan 34,2 gam hỗn hợp gồm Al2O3 và Fe2O3 vào trong 1 lít dung dịch HCl 2M, sau phản ứng còn dư 25% axit. Cho dung dịch tạo thành tác dụng với dung dịch NaOH 1M sao cho vừa đủ đạt kết tủa bé nhất.
1.Tính khối lượng của mỗi oxit trong hỗn hợp.
2.Tính thể tích của dung dịch NaOH 1M đã dùng.
Câu 5. (2 điểm)
Đốt cháy hoàn toàn chất hữu cơ X (MX 2, H2O và N2. Biết số mol H2O bằng 1,75 lần số mol CO2; tổng số mol CO2 và H2O bằng 2 lần số mol O2 tham gia phản ứng. Xác định công thức phân tử của X.
Đáp án & Thang điểm
Câu 1.
1. a
Khí CO2 nặng hơn không khí và không tác dụng với oxi nên nó có tác dụng ngăn không cho vật cháy tiếp xúc với không khí. Do đó CO2 được dùng để giập tắt các đám cháy.
Tuy nhiên với các đám cháy có kim loại mạnh (ví dụ: Mg) thì không được giập lửa bằng CO2 do sẽ làm các đám cháy trở nên nghiêm trọng hơn. Do:
2Mg + CO2 2MgO + C
Cacbon sinh ra lại tiếp tục cháy:
C + O2 CO2
1. b
- Trong tự nhiên có nhiều nguồn tạo ra H2S nhưng lại không có sự tích tụ H2S trong không khí. Vì H2S phản ứng với O2 trong không khí ở điều kiện thường:
2H2S + O2 → 2S + 2H2O
- Trong phòng thí nghiệm, khi nhiệt kế thủy ngân bị vỡ người ta dùng bột lưu huỳnh rắc lên nhiệt kế bị vỡ. Vì Hg rất độc, lại dễ bay hơi. Trong khi đó S có thể tác dụng với Hg ở điều kiện thường tạo ra HgS không bay hơi, giúp dễ xử lý hơn.
Hg + S → HgS
- Trong phòng thí nghiệm bị ô nhiễm khí Cl2, để khử độc người ta xịt vào không khí dung dịch NH3. Do:
2NH3 + 3Cl2 → N2 + 6HCl;
NH3 (k) + HCl (k) → NH4Cl (tt)
Câu 2.
1. Các Phương trình hóa học:
Cho X vào HCl dư:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2 ↑
Dung dịch Y gồm AlCl3, MgCl2, FeCl2, HCl dư.
Khí Z là H2; Chất rắn A là Cu.
Hòa tan A bằng H2SO4 đặc, nóng, dư:
Cu + 2H2SO4 (đặc) CuSO4 + SO2 ↑ + 2H2O
Khí B là SO2. Cho B vào nước vôi trong dư:
SO2 + Ca(OH)2 dư → CaSO3↓ + H2O
Kết tủa D là CaSO3
Cho từ từ dd NaOH đến dư vào Y
NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
2NaOH + MgCl2 → Mg(OH)2 ↓ + 2NaCl
2NaOH + FeCl2 → Fe(OH)2 ↓ + 2NaCl
NaOH dư + Al(OH)3 → NaAlO2 + 2H2O
Chất rắn E là Mg(OH)2, Fe(OH)2
Nung E ta được G là MgO, Fe2O3.
4Fe(OH)2 + O2 2Fe2O3 + 4H2O
Mg(OH)2 MgO + H2O
2.
- Dẫn hỗn hợp khí qua nước vôi trong dư
CO2 + Ca(OH)2 → CaCO3↓+ H2O
Lọc tách kết tủa, cho phản ứng với HCl thu lấy CO2 thoát ra:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
- Hỗn hợp khí còn lại (C2H4, C2H2, C2H6) dẫn thật chậm qua dung dịch AgNO3 / NH3 có dư :
C2H2 +2 AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
Hoặc C2H2 + Ag2O
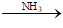
Lọc tách kết tủa rồi cho tác dụng với dung dịch HCl. Thu khí C2H2 thoát ra:
C2Ag2 + 2HCl → C2H2↑ + 2AgCl ↓
- Hỗn hợp còn lại gồm C2H4 và C2H6 cho lội chậm qua dung dịch brom (dư), C2H4 có phản ứng, bị giữ lại. Khí C2H6 không phản ứng với dung dịch brom thoát ra ngoài ,thu khí C2H6
C2H4 + Br2 → C2H4Br2
Cho bột Zn (dư) vào bình chứa dung dịch trên và đun nhẹ, thu khí C2H4
C2H4Br2 + Zn C2H4 ↑ + ZnBr2
Câu 3.
1.
- Điều chế axetilen:
Cho vào ống nghiệm có nhánh 1 – 2 mẩu canxi cacbua. Đặt ống nghiệm lên giá. Đậy miệng ống nghiệm có nhánh bằng nút cao su có ống nhỏ giọt. Nhỏ từng giọt nước từ ống nhỏ giọt vào ống nghiệm, nước chảy xuống tiếp xúc với canxi cacbua, khí axetilen được tạo thành.
CaC2 + 2H2O → C2H2 ↑ + Ca(OH)2
- Thu axetilen vào ống nghiệm:
Cho đầy nước vào một ống nghiệm, úp ngược ống nghiệm vào chậu đựng nước, luồn đầu ống dẫn vào miệng ống nghiệm chứa nước. Axetilen đẩy nước trong ống nghiệm ra, khi ống nghiệm đầy khí, lấy ống nghiệm ra, dùng nút cao su đậy miệng ống nghiệm lại.
- Phản ứng cộng của axetilen:
Cho đầu thủy tinh của ống dẫn khí axetilen sục vào ống nghiệm đựng khoảng 2 ml dung dịch brom, màu của dung dịch brom nhạt dần do axetilen tác dụng với brom.
C2H2 + 2Br2 → C2H2Br4
2. Thí nghiệm trên chứng minh tính dễ tan của hiđroclorua trong nước.
Hiện tượng thí nghiệm: Nước trong chậu theo ống thủy tinh phun vào bình thành những tia nước màu đỏ.
Giải thích hiện tượng:
Khí hiđroclorua tan nhiều trong nước, tạo ra sự giảm mạnh áp suất trong bình, áp suất của khí quyển đẩy nước vào thế chỗ khí HCl đã hòa tan.
Dung dịch thu được là axit nên làm dung dịch quỳ tím chuyển sang màu đỏ.
Câu 4.
Gọi x; y lần lượt là số mol Al2O3 và Fe2O3 trong hỗn hợp ban đầu.
Theo bài ra: mhh = 34,2 gam → 102x + 160y = 34,2 (1)
Số mol HCl ban đầu = 2.1 = 2 mol
Số mol HCl dư =
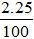
Phương trình hóa học:
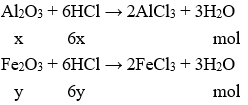
Từ 2 Phương trình hóa học suy ra: 6(x + y) = 1,5 (2)
Từ (1) và (2) suy ra x = 0,1 mol ; y = 0,15 mol
a) Khối lượng mỗi oxit trong hỗn hợp:
mAl2O3 = 0,1.102 = 10,2 gam ;
mFe2O3 = 34,2 – 10,2 = 24 gam.
b) Dung dịch sau phản ứng có chứa: AlCl3 0,2 mol; FeCl3 0,3 mol và HCl dư 0,5 mol.
Phương trình hóa học xảy ra:
HCl + NaOH → NaCl + H2O
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Để khối lượng kết tủa bé nhất thì Al(OH)3 tan hết trong NaOH, do đó kết tủa chỉ có Fe(OH)3
Từ các Phương trình hóa học trên suy ra:
Tổng số mol NaOH cần dùng = nHCl dư + 4.nAlCl3 + 3.nFeCl3
= 0,5 + 4. 0,2 + 3.0,3
= 2,2 mol
Vậy thể tích dung dịch NaOH cần dùng = 2,2/1 = 2,2 lít.
Câu 5.
Đặt CTPT X là: CxHyOzNt (giả sử: 1 mol)
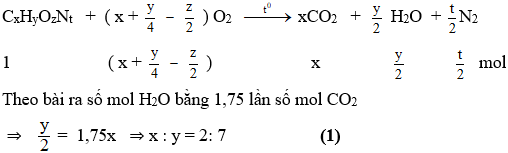
Mặt khác tổng số mol CO2 và H2O bằng 2 lần số mol O2 tham gia phản ứng:
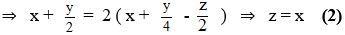
Từ (1) và (2) ⇒ x : y : z = 2:7:2
Công thức phân tử của X có dạng: (C2H7O2Nt)n
Vì MX 2H7O2N
Sở Giáo dục và Đào tạo .....
Trường THPT ....
Kì thi tuyển sinh vào lớp 10
Năm học 2021
Môn: Hóa học (khối chuyên)
Thời gian làm bài: 120 phút
(Đề thi số 2)
Câu 1. (2,5 điểm)
1. Cho các chất: C6H6 (benzen) (l); CH3–CH2–CH3 (k); CH3–C≡CH (k); CH3–CH=CH2 (k); SO2 (k); CO2 (k); FeSO4 (dd); saccarozơ (dd). Chất nào có thể làm nhạt màu dung dịch nước brom, giải thích và viết phương trình phản ứng hóa học xảy ra (nếu có).
2. Viết phương trình phản ứng hóa học xảy ra (nếu có) khi tiến hành nhiệt phân lần lượt các chất rắn sau: NaNO3; KHCO3; Al(OH)3; (NH4)2SO4.
Câu 2. (2 điểm)
1. Viết công thức cấu tạo và gọi tên của tất cả các chất ứng với công thức phân tử C2H4Cl2.
2. Đốt cháy hoàn toàn 3,465gam C2H4Cl2 bằng lượng khí oxi dư, thu được hỗn hợp X (chỉ gồm CO2; O2 dư; hơi nước và khí hiđroclorua). Dẫn từ từ toàn bộ lượng X thu được vào bình kín chứa 925 gam dung dịch Ca(OH)2 0,8%, phản ứng xong thu được dung dịch Y. Tính khối lượng các chất tan có trong dung dịch Y.
Câu 3. (2 điểm)
Nhỏ từ từ dung dịch chỉ chứa chất tan KOH cho đến dư vào lần lượt từng ống nghiệm có chứa các dung dịch (riêng biệt) sau: HCl (có hòa tan một giọt phenolphtalein); MgCl2; Al(NO3)3; FeCl3; Ca(HCO3)2. Giải thích hiện tượng thu được, viết phương trình phản ứng hóa học minh họa.
Câu 4. (3 điểm)
Cho 37,95 gam hỗn hợp bột X (gồm MgCO3 và RCO3) vào cốc chứa 125,0 gam dung dịch H2SO4 a% (loãng). Khuấy đều hỗn hợp cho đến khi phản ứng kết thúc, thu được dung dịch Y; chất rắn Z và 2,8 lít (ở đktc) khí CO2.
Cô cạn dung dịch Y được 6,0 gam muối khan, còn nung chất rắn Z tới khối lượng không đổi thu được 30,95 gam chất rắn T và khí CO2.
a. Tính: a (%); khối lượng (gam) chất rắn Z.
b. Xác định kim loại R, biết trong X số mol của RCO3 gấp 1,5 lần số mol MgCO3.
Đáp án & Thang điểm
Câu 1.
1.
+ Benzen: Brom tan trong benzen tốt hơn tan trong nước, khi cho benzen vào nước brom, benzen sẽ chiết brom từ dung môi nước sang làm cho nước brom nhạt màu (còn dung dịch benzen – brom màu sẽ đậm lên).
+ CH3–C≡CH: Có phản ứng:
CH3–C≡CH + Br2 → CH3–CBr = CHBr
(Hoặc CH3–C≡CH + 2Br2 → CH3–CBr2–CHBr2)
+ CH3–CH=CH2: Có phản ứng
CH3–CH=CH2 + Br2 → CH3–CHBr=CH2Br
+ SO2: Có phản ứng
SO2 + Br2 + H2O → 2HBr + H2SO4
+ FeSO4: Có phản ứng
6FeSO4 + 3Br2 → 2FeBr3 + 2Fe2(SO4)3
+ Các chất không làm mất màu nước brom: CO2; C3H8 và saccarozơ: vì không có phản ứng hóa học xảy ra.
Xem thêm: Thanh Lý Ô Tô Cũ, Xe Hơi Cũ Giá Rẻ Toàn Quốc, Mua Bán Ô Tô Cũ, Xe Hơi Cũ Giá Rẻ Toàn Quốc
2. Các Phương trình hóa học:
2NaNO3 2NaNO2 + O2 ↑(1)
2KHCO3 K2CO3 + CO2 ↑ + H2O (2)
2Al(OH)3 Al2O3 + 3H2O(3)
(NH4)2SO4 2NH3 + H2SO4(4)
Câu 2.
1. Các công thức cấu tạo và tên gọi tương ứng của chất có CTPT C2H4Cl2 là:
CH3–CHCl2 : 1,1–điclo etan
CH2Cl–CH2Cl: 1,2–điclo etan
2.
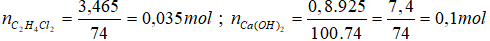
* Phương trình phản ứng cháy:
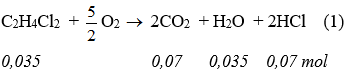
* Trật tự xảy ra phản ứng:
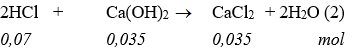
* Số mol Ca(OH)2 sau phản ứng với HCl = 0,1 – 0,035 = 0,065 (mol).
Ta có:
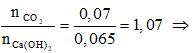
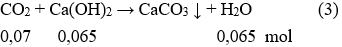
Sau phản ứng (3) CO2 dư 0,07 – 0,065 = 0,005 mol
Tiếp tục có phản ứng:
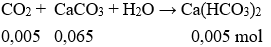
Dung dịch Y gồm các chất tan: CaCl2 0,035 mol và Ca(HCO3)2 0,005 mol
Khối lượng CaCl2 = 0,035. 111 = 3,885(gam);
Khối lượng Ca(HCO3)2 = 0,005.162 = 0,81 (gam)
Câu 3.
* dd HCl có hòa tan một giọt phenolphtalein không có màu. Khi nhỏ KOH vào dung dịch này: ban đầu không có màu (do HCl trung hòa KOH mới cho vào) sau đó dung dịch chuyển sang màu hồng (do KOH dư).
Phương trình hóa học:
KOH + HCl → KCl + H2O
* Nhỏ KOH đến dư vào dd MgCl2
Hiện tượng: xuất hiện kết tủa trắng không tan khi KOH dư.
Phương trình hóa học:
2KOH + MgCl2 → Mg(OH)2 (↓ trắng) + 2KCl
* Nhỏ KOH đến dư vào dd Al(NO3)3:
Hiện tượng: ban đầu xuất hiện kết tủa keo trắng sau đó kết tủa tan khi KOH dư.
Phương trình hóa học:
3KOH + Al(NO3)3 → Al(OH)3 (↓ keo trắng) + 3KNO3
KOH dư + Al(OH)3 ↓ → KAlO2 + 2H2O
* Nhỏ KOH đến dư vào dd FeCl3:
Hiện tượng: xuất hiện kết tủa màu đỏ nâu, kết tủa không tan khi KOH dư.
Phương trình hóa học:
3KOH + FeCl3 → Fe(OH)3 (↓ đỏ nâu) + 3KCl
* Nhỏ KOH đến dư vào dd Ca(HCO3)2:
Hiện tượng: xuất hiện kết tủa trắng, kết tủa không tan khi KOH dư.
Phương trình hóa học:
2KOH + Ca(HCO3)2 → CaCO3 (↓ trắng) + K2CO3 + 2H2O
Câu 4.
a/
- Cho X phản ứng với H2SO4 (Thí nghiệm 1)
Số mol CO2 thu được là:
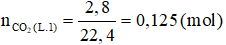
* Nung Z thu được CO2 → ở thí nghiệm 1 axit H2SO4 tham gia pư hết; X dư.
Đặt hỗn hợp X (gồm MgCO3 và RCO3) tương đương với muối MCO3.
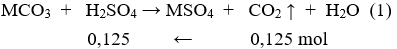
Số mol H2SO4 = số mol CO2 = 0,125 (mol)
Nồng độ % của dung dịch H2SO4 là:
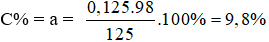
* Số mol gốc sunfat SO42- trong muối = số mol CO2;
Khối lượng SO42- trong muối = 0,125.96 = 12,0 gam > khối lượng muối rắn khan khi cô cạn dung dịch Y. Vậy trong hai muối sunfat tạo thành có 01 muối tan được trong nước (là MgSO4) và 01 muối không tan trong nước (là RSO4).
Vậy dd Y là MgSO4; Chất rắn Z là MCO3 dư và RSO4 không tan.
* Số mol MgSO4 =
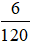
Số mol RSO4 = 0,125 – 0,05 = 0,075mol
* Chất rắn Z là MCO3 dư và RSO4 không tan; do đó:
mZ = 37,95 + 0,075(96 – 60) – 0,05.84 = 36,45(gam).
b/
mZ – mT = mCO2 = 36,45 – 30,95 = 5,5(gam).
Số mol CO2 thu được sau khi nung Z =
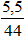
Đặt nMgCO3 = x (mol) ⇒ nRCO3 = 1,5x (mol)
Bảo toàn C: x + 1,5x = (0,125 + 0,125) = 0,25 → x = 0,1 mol
Khối lượng của RCO3 = 37,95 – 0,1.84 = 29,55 (gam)
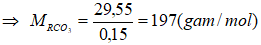
Vậy R là Ba.
Sở Giáo dục và Đào tạo .....
Trường THPT ....
Kì thi tuyển sinh vào lớp 10
Năm học 2021
Môn: Hóa học (khối chuyên)
Thời gian làm bài: 120 phút
(Đề thi số 3)
Cho: Ca = 40, Al = 27; Fe = 56; C = 12; H = 1; O = 16; Ba = 137;
Câu 1. (2,5 điểm)
1. Chỉ được dùng một kim loại duy nhất (các dụng cụ cần thiết coi như có đủ), hãy phân biệt các dung dịch đựng trong các lọ mất nhãn sau: K2SO4, Fe(NO3)3, Al(NO3)3, NaCl.
2. Cho một luồng khí H2 (dư) lần lượt đi qua 5 ống mắc nối tiếp đựng các oxit được nung nóng (như hình vẽ):

Hãy xác định các chất trong từng ống sau thí nghiệm và viết các phương trình hóa học xảy ra.
Câu 2. (2,5 điểm)
1. Từ tinh bột và các chất vô cơ cần thiết, hãy viết các phương trình hóa học điều chế: Rượu etylic, polietilen, axit axetic, etyl axetat, metyl clorua, poli (vinyl clorua).
2. Một học sinh yêu thích môn hóa học, trong chuyến đi thăm động Thiên Cung (vịnh Hạ Long) có mang về một lọ nước (nước nhỏ từ nhũ đá trên trần động xuống). Học sinh đó đã chia lọ nước làm 3 phần và làm các thí nghiệm sau:
- Phần 1: Đun sôi
- Phần 2: Cho tác dụng với dung dịch HCl
- Phần 3: Cho tác dụng với dung dịch NaOH
Hãy nêu hiện tượng và viết các phương trình hóa học có thể xảy ra.
Câu 3. (2,5 điểm)
Hỗn hợp Z gồm một hiđrocacbon A và oxi (lượng oxi trong Z gấp đôi lượng oxi cần thiết để đốt cháy hết A). Bật tia lửa điện để đốt cháy hỗn hợp Z, đến khi kết thúc phản ứng thì thể tích khí và hơi sau khi đốt không đổi so với ban đầu. Nếu cho ngưng tụ hơi nước của hỗn hợp sau khi đốt thì thể tích giảm đi 40% (biết rằng các thể tích khí và hơi đều đo ở cùng điều kiện nhiệt độ và áp suất).
1. Xác định công thức phân tử của A.
2. Đốt cháy hoàn toàn 8,96 lít khí A (đo ở đktc) rồi cho toàn bộ sản phẩm vào dung dịch chứa 51,3 gam Ba(OH)2 thì khối lượng của dung dịch tăng hay giảm, bao nhiêu gam?
Câu 4. (2,5 điểm)
Hỗn hợp A1 gồm Al2O3 và Fe2O3. Dẫn khí CO qua 21,1 gam A1 và nung nóng thu được hỗn hợp A2 gồm 5 chất rắn và hỗn hợp khí A3. Dẫn A3 qua dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa. A2 tác dụng vừa đủ với 1 lít dung dịch H2SO4 0,5M thu được dung dịch A4 và có 2,24 lít khí thoát ra (đo ở đktc).
Tính % khối lượng mỗi chất trong hỗn hợp A1.
Đáp án & Thang điểm
Câu 1.
1. Chọn kim loại Ba để nhận biết.
Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng
(trích mẫu thử)
Cho từng mẩu Ba vào các mẫu thử:
+ Mẫu nảo sủi bọt khí đồng thời tạo kết tủa trắng là K2SO4.
Phương trình hóa học:
Ba + 2H2O → Ba(OH)2 + H2 ↑
Ba(OH)2 + K2SO4 → BaSO4 (↓ trắng) + 2KOH
+ Mẫu nào sủi bọt khí đồng thời tạo kết tủa nâu đỏ là Fe(NO3)3
Phương trình hóa học:
Ba + 2H2O → Ba(OH)2 + H2 ↑
3Ba(OH)2 + 2Fe(NO3)3 → 2Fe(OH)3 (↓ nâu đỏ) + 3Ba(NO3)2
+ Mẫu nào sủi bọt khí và tạo kết tủa trắng keo, sau đó kết tủa tan là Al(NO3)3
Ba + 2H2O → Ba(OH)2 + H2 ↑
3Ba(OH)2 + 2Al(NO3)3 → 2Al(OH)3 (↓ trắng keo) + 3Ba(NO3)2
2Al(OH)3 (↓) + Ba(OH)2 → Ba(AlO2)2 + 4H2O
+ Mẫu nào chỉ sủi bọt khí và không thấy có kết tủa là NaCl
Phương trình hóa học:
Ba + 2H2O → Ba(OH)2 + H2 ↑
2.
+ Ống 1: Không có phản ứng nên sau thí nghiệm vẫn là MgO
+ Ống 2: Có phản ứng:
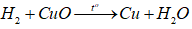
Do H2 dư nên sau thí nghiệm chất rắn trong ống 2 là Cu.
+ Ống 3: Không có phản ứng nên sau thí nghiệm vẫn là Al2O3.
+ Ống 4: Có các phản ứng:
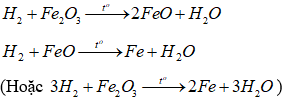
Do H2 dư nên sau thí nghiệm chất rắn trong ống 4 là Fe
+ Ống 5: Không có phản ứng nên sau thí nghiệm vẫn là Na2O.
Câu 2.
1. Các phản ứng hóa học điều chế:
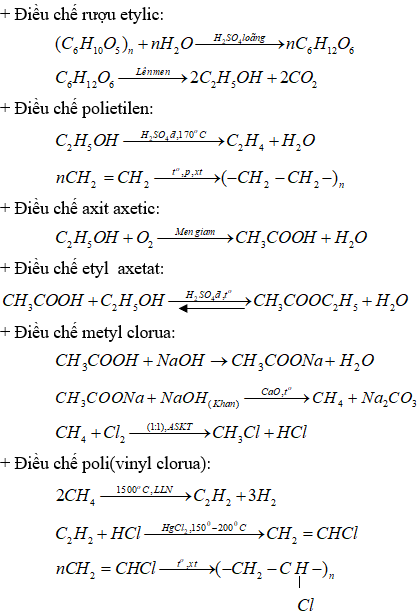
2. Lọ nước bạn học sinh mang về là dung dịch chứa chủ yếu Ca(HCO3)2
+ Phần 1: Đun sôi có cặn trắng và khí xuất hiện do phản ứng:
Ca(HCO3)2 CaCO3 + CO2 ↑ + 2H2O
+ Phần 2: Cho tác dụng với dung dịch HCl có khí thoát ra do phản ứng:
Ca(HCO3)2 + 2HCl → CaCl2 + CO2 ↑ + 2H2O
+ Phần 3: Cho tác dụng với dung dịch NaOH có kết tủa trắng do phản ứng:
Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
Câu 3.
1. Đặt công thức của A là: CxHy (ĐK: x, y thuộc N*) và thể tích của A đem đốt là a (lít), (a > 0). Phản ứng đốt cháy A.
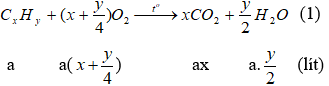
Theo giả thiết lượng oxi đã dùng gấp đôi lượng cần thiết và đến khi kết thúc phản ứng thì thể tích khí và hơi sau khi đốt không đổi so với ban đầu nên ta có phương trình:
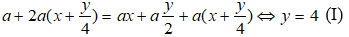
Sau khi ngưng tụ hơi nước thì thể tích giảm 40% do vậy:
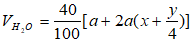
Mặt khác theo (1) thì
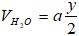
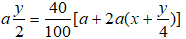
Thay (I) vào (II) ta có ⇔ x = 1 ⇒ Công thức phân tử của A là CH4.
2.
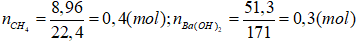
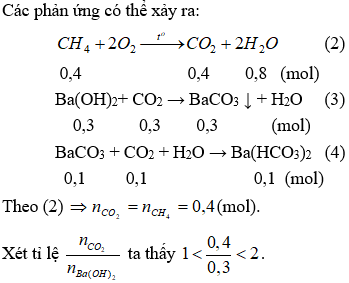
Do vậy xảy ra cả (3) và (4). Lượng BaCO3 sinh ra cực đại ở (3) sau đó hòa tan một phần theo (4).
Theo (3) nBaCO3 = nCO2 = nBa(OH)2 = 0,3 (mol)
Số mol CO2 tham gia phản ứng ở (4) là: (0,4 - 0,3) = 0,1 (mol).
Theo (4) ⇒ nBaCO3 = nCO2 = 0,1 (mol).
Vậy số mol BaCO3 không bị hòa tan sau phản ứng (4) là: nBaCO3 = 0,3-0,1 = 0,2 (mol).
Ta có: mBaCO3 - mCO2 + mH2O = 0,2.197 - (0,4.44 + 0,8.18) = 7,4 (gam)
Vậy khối lượng dung dịch giảm đi 7,4 gam.
Câu 4.
Gọi số mol của Al2O3 và Fe2O3 trong A1 lần lượt là a và b mol.
Số mol oxi nguyên tử trong A1 là: nO = 3a + 3b mol
Theo giả thiết ta tính được: nH2SO4 = 1.0,5 = 0,5(mol).
Các phản ứng có thể xảy ra:
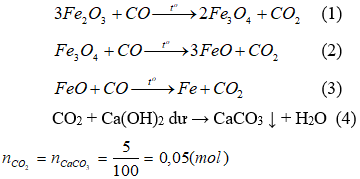
A2 gồm: Al2O3, Fe2O3, Fe3O4, FeO, Fe. Khí A3 là CO và CO2;
A2 tác dụng với dung dịch H2SO4 loãng thu được khí đó là khí H2
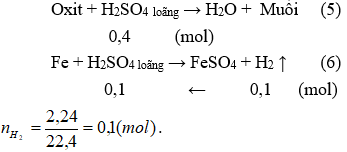
Số mol nguyên tử oxi trong A1 bằng tổng của số mol nguyên tử oxi trong A2 và số mol nguyên tử oxi chuyển từ CO thành CO2 (hay số mol CO2 ).











